Il sale
Il Sale
Il sale di sodio dell'acido cloridrico è il comune sale da cucina. A temperatura ambiente si presenta come un solido cristallino incolore e inodore, dal sapore caratteristico. I suoi cristalli hanno un reticolo cubico ai cui vertici si alternano ioni sodio Na+ e ioni cloruro Cl−. In soluzione acquosa oppure fuso, conduce la corrente elettrica.
Usi
Il sale è anzitutto un esaltatore di sapidità usato in tutte le tradizioni culinarie conosciute ed è ampiamente sfruttato nell'industria conserviera sia come ingrediente che come mezzo di conservazione dei cibi. Quest'ultima proprietà è dovuta all'effetto disidratante che il sale ha sui materiali con cui viene a contatto, da cui estrae l'acqua per osmosi.
Sale da cucina additivato di elementi particolari può essere prescritto per curare o prevenire alcune malattie (ad esempio il sale iodato per il gozzo o addizionato di cloruro di potassio per l'ipertensione).
Il sale è anche un reagente usato in chimica, ad esempio per migliorare la precipitazione dei prodotti al termine di una saponificazione. Un uso importante nell'industria chimica è come materia prima negli impianti cloro-soda, in cui viene eseguita l'elettrolisi della salamoia di cloruro di sodio per ottenere cloro gassoso, idrogeno e soda caustica, tutte materie prime fondamentali per l'industria chimica.
Il sale trova impiego anche come anti-gelo: sparso sulle superfici ghiacciate, ne provoca lo scioglimento, dato che una miscela di ghiaccio e sale forma un eutettico il cui punto di fusione è inferiore ai −10 °C.
Produzione
Il cloruro di sodio si trova abbondantemente in natura. La maggior parte è disciolta in acqua, a formare acqua marina; in parte si trova allo stato solido in giacimenti di terraferma. I processi di produzione variano a seconda della forma in cui il cloruro di sodio è disponibile.
Il costo di produzione del sale è di 50 Euro per tonnellata ed è il prodotto in vendita nella grande distribuzione con il prezzo unitario più basso, arrivando fino a 11 centesimi di Euro al chilogrammo. Il sale non scade, si conserva per anni, anche nei magazzini all'aperto.[senza fonte]
Evaporazione solare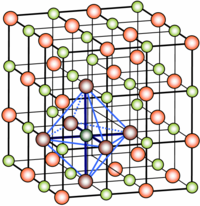
È la forma più antica di produzione, fatta in stabilimenti detti saline. Viene fatta solitamente a partire dall'acqua di mare, che viene raccolta in vasche impermeabilizzate di grande estensione e bassa profondità; l'acqua di mare staziona nelle vasche e, per effetto dell'irraggiamento solare, la salamoia si concentra. Poiché durante la concentrazione si verifica la precipitazione di sali diversi dal cloruro di sodio, la salamoia stessa viene trasferita, col crescere della concentrazione, a vasche diverse. Le prime vasche, in cui non si ha precipitazione, sono dette evaporanti; quelle in cui precipitano i sali di calcio (se esistono) decalcificanti. Raggiunta la concentrazione di circa 300 g/l di NaCl, la salamoia viene passata nelle vasche cristallizzanti, in cui si ha precipitazione del cloruro di sodio.
Il cloruro di sodio solido depositatosi sul fondo delle vasche cristallizzanti viene quindi raccolto con macchine dette coltivatori ed inviato alla fase successiva di raffinazione.
Scopo della raffinazione è l'eliminazione dei sali diversi dal cloruro di sodio. Tale eliminazione si ottiene mediante lavaggio in controcorrente con acqua quanto più pura possibile: si ottiene così un cloruro di sodio con titolo di NaCl oltre il 99,5 %, che viene essiccato e commercializzato come sale marino.
Un sale è un composto chimico ottenuto sostituendo gli atomi di idrogeno di un acido con atomi metallici o con un gruppo funzionale che abbia comportamento metallico (per esempio il gruppo ammonio, NH4)
Un sale può essere organico o inorganico.
In generale, i sali sono composti ionici costituiti da atomi appartenenti a un reticolo cristallino. Presentano caratteristiche esteriori variabili e diverse (colore, odore, sapore, trasparenza) a seconda della loro composizione. Possono essere molto solubili o completamente insolubili in acqua, dove i due gruppi uniti da legame ionico si dissociano. Sono altresì solubili in altri solventi, e tipicamente i sali formati da elettroliti forti si sciolgono bene in solventi polari. I sali hanno punto di fusione variabile, spesso bassa durezza, e bassa comprimibilità. Se fusi o dissolti in acqua son detti elettroliti e conducono elettricità proporzionalmente all'elettronegatività degli atomi costituenti, comportandosi da conduttori di seconda specie.
I due elementi di un sale binario (come ad esempio il cloruro di sodio) possono essere separati per elettrolisi del sale fuso.
Ciò che comunemente viene chiamato sale o sale da cucina è in realtà uno dei tanti sali possibili, cioè il cloruro di sodio (NaCl).
Le regole di nomenclatura usate in chimica assegnano ai sali nomi a partire dagli ioni che li costituiscono. Frequentemente nomi dei componenti cationici, spesso ioni metallici o ammonici, sono dati per primi, seguiti dai nomi del componente anionico. Gli anioni sono spesso chiamati in accordo al loro acido coniugato, sostituendo il suffisso -idrico con il suffisso -uro, il suffisso -oso con il suffisso -ito e il suffisso -icocon il suffisso -ato; alcuni esempi:
- acetati sono sali dell'acido acetico
- carbonati sono sali dell'acido carbonico
- cloruri sono sali dell'acido cloridrico
- cianuri sono sali dell'acido cianidrico
- nitrati sono sali dell'acido nitrico
- nitriti sono sali dell'acido nitroso
- fosfati sono i sali dell'acido fosforico
- solfati sono sali dell'acido solforico
- fluoruri sono i sali dell'acido fluoridrico


